|
Antimicrobianos son productos elaborados durante el metabolismo microbiano capaces de inhibir parcial o totalmente la multiplicación y crecimento de microorganismos. Estas substancias son clasificadas como antibióticos (substancias químicas producidas por microorganismos) y como quimioterápicos (substancias sintetizadas o productos microbianos modificados estructuralmente en laboratório). El uso de esas substancias químicas revolucionó el tema de las infecciones y su suceso generó grande optimismo en relación a la prevención e al tratamiento de los procesos infecciosos. Entretanto, la prescripción ni siempre criteriosa o racional de eses antimicrobianos, rapidamente generó dificultades para su uso, devido a la progresiva resistencia bacteriana a esas drogas (Montelli & Sadatsune, 2001).
La resistencia a agentes antimicrobianos no es un fenomeno reciente. La detección de las β-lactamasas, tanto en bactérias Gram-positivas cuanto en Gram-negativas, se remonta al início de los años 40, antes del uso generalizado de la penicilina en todo el mundo (Abraam & Chain, 1940; Kirby, 1944). La producción de enzimas β-lactamasas, ha sido relatada como un importante mecanismo de resistencia a antibióticos β-lactámicos, hidrolisando el anillol beta-lactámico por la quiebra de la ligación amida, perdiendo asi, la capacidad de inhibir la síntesis de la pared celular bacteriana (Williams, 1999). Las β-lactamasas pueden ser detectadas en Enterobacteriaceae, Haemophilus influenza, Neisseria gonorrhoeae, Vibrio cholerae, Pseudomonas aeruginosa, Moraxella spp., (GARAU, 1994) y anaeróbios, tales como las espécies del grupo Bacteroides fragilis, cepas de Prevotella que producen pigmento, Porphyromonas spp., Bilophila wadsworthia, Fusobacterium spp. y Clostridium spp. (Summanen et al., 1993; Könönen et al., 1998). La producción de esa enzima por un microorganismo explica porqué de su sobrevivencia en un foco infeccioso, apesar del uso de un antibiótico β-lactámico. Además, la presencia de esos microorganismos productores de β-lactamasa puede favorecer la sobrevivencia de otros microorganismos sensibles al antibiótico en un proceso infeccioso (Tavares, 2001). El aparecimiento y la diseminación de microorganismos con múltipla resistencia a las drogas estan ocurriendo tanto en hospitales como en las comunidades. Esto puede ser resultado de la interacción de vários factores, siendo talvez el mas importante, la presión selectiva ejercida por las drogas sobre los microorganismos, dificultando asi, su sobrevivencia en presencia de agentes antimicrobianos (McGowan & Tenover, 1997). Por otro lado, no puede olvidar el intercambio de informaciones genéticas entre microorganismos, con transferencia de gens para nuevos hospedes, y las mutaciones que puedem ocurrir en gens de resistencia ampliando su espectro de resistencia (DeFlaun & Levy, 1989; Tenover & Hughes, 1996). Mutaciones en gens de resistencia aumentan el espectro de actividade de las β-lactamasas de amplio espectro o espectro extendido (ESBL – Extended Spectrum β-lactamases) (Philippon et al., 1989). Las enzimas ESBL son capaces de hidrolisar las cefalosporinas de amplio espectro, como la cefotaxima y ceftazidima, y los monobactámicos, como aztreonam (Jacoby & Medeiros, 1991). Estudios han sugerido que la presión selectiva causada por el uso constante de cefalosporinas en los centros de salúd contribuye para el aparecimiento y diseminación de esos microorganismos resistentes (Rice et al., 1990; Coundron et al., 1997). Monnet et al. (1997) observaron que la resistencia bacteriana causada por la produción de ESBL puede aumentar en un periodo de 2 años en 57% en un único hospital. La presencia de microorganismos que expresan nuevas enzimas capaces de hidrolisar carbapenemicos, como imipenem y meropenem, viene cada vez mas siendo observada (Rasmussen & Bush, 1997). MECANISMOS DE ACCIÓNLa hidrólisis del anillo beta-lactámico del núcleo estructural de las penicilinas - el ácido 6-aminopenicilámico - provoca la formación de ácido penicilóico sin actividad antimicrobiana. Consecuentemente la quiebra de este anillo en las diversas penicilinas forma derivados del ácido penicilóico, igualmente inactivos. De forma similar, ocurre con las cefalosporinas y carbapenemicos (Tavares, 2001). Los antibióticos beta-lactámicos son clasificados por la semejanza estructural adicionados de radicales que dan la estabilidad de esa droga (Figura 1). 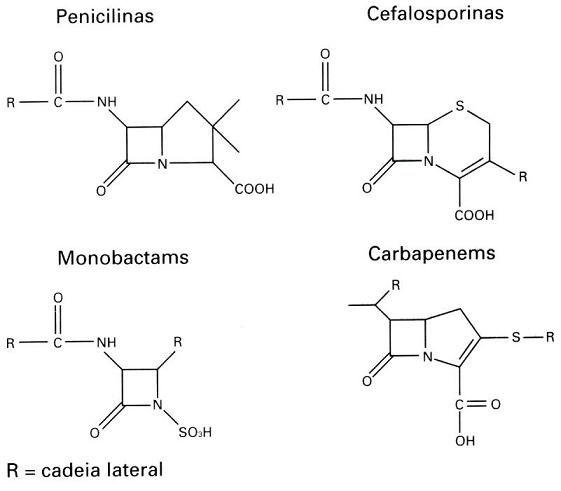
Figura 1. Estructura de los antibióticos β-lactámicos (Williams, 1999). TIPOS DE ENZIMA BETA-LACTAMASASLas β-lactamasas pueden ser encontradas extracelularmente en bactérias Gram-positivas, o en el espacio periplasmático en bactérias Gram-negativas (Bush, 1988). Los gens que codifican la producción de esas enzimas pueden estar localizados en el cromosoma bacteriano o en plasmídios. Las β-lactamasas de origen cromosómica son universales en algunas espécies bacterianas, en cuanto que, aquellas de origen plasmídial son variables, permitiendo que esos elementos sean transferidos entre espécies. La mobilidad genética puede ser ampliada por medio de transposons, los cuales transportan los gens de la β-lactamasa desde los plasmídios hasta los cromosomas. Esta mobilidad es importante, pues permite que los gens resistentes se diseminen através de las diversas comunidades bacterianas (Williams, 1999). Apesar de todas las β-lactamasas catalisem la misma reacción, determinados tipos de esas enzimas han sido aisladas y caracterizadas. Asi, esas enzimas fueron clasificadas segun la estructura primária (clase A a D), y las características funcionales y bioquímicas (grupo I a IV). Enzimas clasificadas como clase A o grupo II, hidrolisam penicilinas y cefalosporinas; clase B o grupo III, carbapenemicos; clase C o grupo I, cefalosporinas; clase D, penicilinas y cloxacilina; y grupo IV (penicilinases) (Ambler, 1980; Bush et al., 1995). Los efectos de la enzima varian segun la distribución en las diferentes espécies bacterianas, la prevalencia de producción de la β-lactamasa dentro de cada espécie y la prevalencia en espécies patogénicas. Considerandose entonces, esos tres factores, las enzimas de la clase A mediadas por plasmídios son consideradas las mas importantes por sus efectos en la práctica clínica, incluyendose las ESBL (Nicolas-Chanoine, 1996). Las cepas bacterianas que producem las enzimas de la clase A: TEM-1, SHV-1, ROB-1 o PC-1 son resistentes a la amoxicilina y a la ticarcilina y apresentan susceptibilidad reducida a la piperacilina (Jacoby & Sutton, 1985; Livermore & Yang, 1987). Esas enzimas son inhibidas por otros beta-lactámicos denominados de inhibidores de β-lactamasa como sulbactam, tazobactam y ácido clavulánico, asi las cepas que las producem son sensíbles a las associaciones de antibióticos β-lactámicos - inhibidores de beta-lactamasa (Livermore, 1995). Entre las enzimas de la clase A mediadas por plasmídeos, las penicilinasas se destacan porque ocurrem en una grande variedad de patógenos, incluyendo estafilococos, enterococos, Moraxella catarrhalis, Neisseria, Haemophilus, Bacteroides, Pseudomonas, Acinetobacter, y miembros de la família Enterobacteriaceae (Nicolas-Chanoine, 1996). La mayoria (90%) de las cepas de Staphylococcus aureus produce penicilinasas (Lacey, 1984), y como consecuencia de eso hubo el desenvolvimiento de nuevas penicilinas resistentes a las beta-lactamasas direccionadas al S. aureus, tales como oxacilina y meticilina. Penicilinasas tambien son producidas por 9-30% de H. influenzae que causan otitis média (Doern et al., 1988) y en 60-80% de M. catarrhalis envueltas en broncopneumonia (Calder et al., 1986). Las espécies del grupo Bacteroides fragilis tambiem estan asociadas a una elevada (> 80%) producción de esa enzima (Nakano & Avila-Campos, 2004). Infecciones envolviendo estos microorganismos geralmente son tratadas con una asociación de penicilina + inhibidor de β-lactamasa o metronidazol, a pesar de cefoxitina o carbapenémicos tambien pueden ser usados (Aldridge et al., 2001; Wexler et al., 2001). Entre las enterobactérias, Escherichia coli es la espécie mas frecuentemente encontrada tanto en las infecciones adquiridas en la comunidad como en las hospitalares. Cerca de 40-50% de las E. coli, particularmente aquellos aislados de infecciones del tracto urinário (ITU) producem penicilinasas (Henquell et al., 1995). Las espécies de Klebsiella pneumoniae pueden producir β-lactamasas codificadas por cromosoma o por plasmídeo (Liu et al., 1992). Entre los otros miembros de la família Enterobacteriaceae 10% de Enterobacter cloacae producen penicilinasas. En Pseudomonas aeruginosa que es responsable por 9-12% de las infecciones hospitalares y en las UTI la prevalencia de cepas resistentes a la tricarcilina es 10% a 30% (Vicent et al., 1995; Chen et al., 1995). Ya las β-lactamasas de la clase C son producidas por vários miembros de la família Enterobacteriaceae, incluyendo las espécies Enterobacter y Serratia, Morganella morganii, Citrobacter freundii y Acinetobacter baumannii, asi como P. aeruginosa y E. coli produce cefalosporinasa, pero esa enzima se manifiesta de manera constitutiva, en niveles bajos y no presenta acción contra los antibióticos β-lactámicos. De modo inverso, la produción de la cefalosporinasa en otras espécies, puede ser inducida y regulada por proteínas activadoras o represoras (Lindberg & Normark, 1986; Honoré et al., 1989; Jarvis & Martine, 1991). Entretanto, el impacto de esas enzimas en la terapia antibacteriana varía de acuerdo con su modo de expresión. Por ejemplo, las cefalosporinas de amplio espectro con una cadena lateral oximino, tales como cefotaxima, ceftazidima y ceftriaxona, y el monobactámico aztreonam, fueron lanzadas en los años 60 objetivandose la acción contra los patógenos Gram-negativos, porque esas drogas no eran hidrolisadas por las β-lactamasas de origen plasmidial. Entretanto, en poco tiempo fue relatada la presencia de aislados clínicos resistentes a uno o mas de esos antibióticos, que podrian propagar esta resistencia através de plasmídeos transmisíbles y que eran capazes de hidrolisar oximino-β-lactámicos. Las enzimas envueltas fueron llamadas de β-lactamasas de espectro extendido (ESBLs) derivadas de enzimas mediadas por plasmídeos (Medeiros, 1997). Várias β-lactamasas de origen plasmidial son producidas por patógenos Gram-negativos, siendo la enzima mas comum la TEM-1. La β-lactamasa TEM-1 ha sido considerada una enzima totalmente eficiente (Bush et al., 1995). Hidrolisa la penicilina y los derivados de penicilina, tales como ampicilina, carbenicilina y piperacilina. Es tambiem bastante activa contra la cefalotina y la cefuroxima, pero presenta actividad insignificante contra cefotaxima, ceftazidima, ceftriaxona o aztreonam, y no possue ninguna ación contra las cefamicinas (cefoxitina o cefotetan). La TEM-1 posee un isotipo menos comun, llamado de TEM-2, una enzima con propiedades cinéticas idénticas, pero con la diferencia de poseer un único aminoácido, que cambia el punto isoeclétrico (pI) de la proteína de 5,4 a 5,6. En la espécie K. pneumoniae la enzima llamada SHV-1 es el tipo mas comun encontrado en los plasmídeos y es tambiem determinada por genes cromosómicos (Leung et al., 1997). La enzima SHV-1 posee 68% de aminoácidos idénticos a los del TEM-1 y un pI de 7,6. El grupo OXA contiene una série menos comun de β-lactamasas codificados por plasmídeos, caracterizadas por hidrolisar oxacilina, floxacilina y meticilina, pero que no presentan cualquier actividade contra los substratos oximino, TEM-1, TEM-2 y SHV-1. Las enzimas del grupo OXA, son rapidamente inhibidas poe el ácido clavulánico, sulbactam y tazobactam (Jacoby, 2000). Actualmente, son conocidas 61 ESBL en la família TEM-1, 12 en la família SHV y 6 en la família OXA. Ellas son tan numerosas que fue creada umn página en la Internet para documentar sus propiedades ( www.lahey.org/studies/webt.htm). www.lahey.org/studies/webt.htm). Las enzimas ESBL fueron observadas inicialmente en bacilos Gram-negativos aislados en pacientes de Europa y fueron en seguida encontrados en los Estados Unidos (Quinn et al., 1989). Actualmente, esas enzimas son descritas en nivel mundial (Philippon et al., 1994). Este tipo de resistencia es comun, principalmente en K. pneumoniae y, en menor grado, en E. coli. La ESBLs tambiém son encontradas en Citrobacter diversus, C. freundii, E. cloacae, Enterobacter aerogenes, Proteus mirabilis, P. aeruginosa, K. oxytoca, S. marcescens y Salmonella spp. (Jacoby, 2000). INHIBIDORES DE BETA-LACTAMASASDos estratégias bacterianas han sido utilizadas para superar la resistencia de los beta-lactámicos a la β-lactamasa. La primera es la modificación de la estructura del antibiótico de forma que no haya mas substrato para la enzima hidrolisar, y la segunda por la inhibición de la enzima por un compuesto que sea estructuralmente relacionado al substrato beta-lactámico (Moosdeen, 1996). Los inhibidores de β-lactamasas son estructuralmente semejantes a las penicilinas, reteniendo la unión amida del grupo beta-lactámico, peroposeen una cadena lateral modificada (Figura 2). Tales aspectos estructurales permiten a los inhibidores unirse irreversiblemente a las β-lactamasas como substratos suicidas, manteniendolas inactivas. Actualmente, tres inhibidores de β-lactamasa son frecuentemente usadas en la clínica médica, sulbactam, tazobactam y ácido clavulânico (Williams, 1999). 
Figura 2. Estructura de los inhibidores de β-lactamasa (WILLIAMS, 1999). La combinación de un agente β-lactámico y un inhibidor de β-lactamasa ha mostrado ser una buena opción de tratamiento, yá que el inhibidor inactivará la acción de la enzima permitiendo que las penicilinas, las cuales son eficientes y bien toleradas continuen a tratar las mas variadas infecciones (Williams, 1999). IMPORTANCIA CLÍNICA DE LAS BETA-LACTAMASASLa incidencia cresciente de la producción de β-lactamasas por patógenos presentes en la comunidad como en hospitales, han ejercido un impacto considerable en la manera de prescrivir los antimicrobianos. En el tratamiento de infecciones comunes adquiridas por la comunidad tales como infecciones del tracto urinário (ITU), otitis média o broncopneumonia, el uso de penicilinas han disminuído, aumentando asi, el uso de asociaciones de penicilinas o cefalosporinas de segunda y tercera generación con algun inhibidor de β-lactamasa (Nicolas-Chanoine, 1996). Los microorganismos productores de ESBL ocurrem con frecuencia en surtos y causan un dilema terapeutico debido al padrón de resistencia a múltiplas drogas. Eses microorganismos tambiém causan una preocupación con el control de la infección debido a la diseminación de cepas de paciente para paciente, y por el aparecimiento de cepas policlonales debido a la transmisión de elementos genéticos entre cepas y gêneros distintos de bacilos Gram-negativos (Patterson, 2000). Las características epidemiológicas de los surtos de ESBL han sido estudiadas por vários investigadores. Dentro de los factores de riesgo asociados a la adquisición de micororganismos que producem ESBL, podemos citar el uso de cateteres (arterial, venoso central y urinário), colonización intestinal, duración en la UTI o en el hospital, administración anterior de ceftazidima o aztreonam, cirurgia abdominal de emergencia y asistencia ventilatória (DeChamps et al., 1991; Schiappa et al., 1996; Lucet et al., 1996; Piroth et al., 1998). Medidas para controlar surtos fueron relatadas incluyendo la restricción al uso de oximino-beta-lactámico (especialmente ceftazidima) y un control rígido de las infecciones con enfasis en los cuidados de barrera y lavage de las manos. El tracto intestinal es un reservatório de microorganismos que producem ESBL, asi, la antisepsis intestinal ha sido tambiem usada para el control de surtos en las UTI (Brun-Buisson et al., 1989; Peña et al., 1998). La evaluación de los tratamientos para el combate a las infecciones debido a los microorganismos que producen ESBL es complicada por la diversidad de los tipos de esa enzima y por la variedad de factores que pueden modificar su expresión. Los resultados pueden ser influenciados por el tipo de infección y dependiendo si el paciente está efectivamente infectado o apenas colonizado. Frecuentemente los pacientes estan infectados con vários patógenos necesitando de múltiplos agentes antimicrobianos. También, es importante mencionar que, cambios significativos de uso de antibióticos tambiém ejercem una presión selectiva para nuevos microorganismos resistentes (Jacoby, 2000). CONCLUSIONESEn la era de los antibióticos, las β-lactamasas mostraron ser extremamente adaptables. Aparecieron en nuevos huespedes, cambiarón su expresión para niveles mas altos, alterarón su susceptibilidad a los inhibidores y aumentarón la variedad de substratos. Los principales tipos moleculares de las β-lactamasas en los patógenos Gram-negativos son codificados por gens localizados en plasmídeos conjugables o transposons, facilitando asi, la diseminación de la resistencia a los β-lactámicos, pero tambiém promoviendo la co-selección en relación a otros antibióticos. Las bactérias son capazes de evolución rápida en respuesta a la presión selectiva ejercida por el uso generalizado de antibióticos, y asi, los cambios continuados observados en las características de las β-lactamasas no debem ser sorpresas.  REFERENCIAS1. ABRAAM, E.P.; CHAIN, E. An enzyme from bacteria able to destroy penicillin. Nature, 146: 837, 1940. 2. ALDRIDGE, K.E.; ASHCRAFT, D.; CAMBRE, K.; PIERSON, C.L.; JENKINS, S.G.; ROSENBLATT, J.E. Multicenter survey of the changing in vitro antimicrobial susceptibility of clinical isolates of Bacteroides fragilis group, Prevotella, Fusobacterium, Porphyromonas, and Peptostreptococcus species. Antimicrob. Agents Chemother., 45:1238-1243, 2001. 3. AMBLER, R.P. The structure of β-lactamases. Philos. Trans. R. Soc. London Ser., 27: 321-331, 1980. 4. BRUN-BUISSON, C. et al. Intestinal decontamination for control of nosocomial multiresistant gram-negative bacilli: study of an outbreak in an intensive care unit. Ann. Intern. Med., 110: 873-881, 1989. 5. BUSH, K. β-lactamase inhibitors from laboratory to clinic. Clin. Microbiol. Rev., 1: 109-123, 1988. 6. BUSH, K., JACOBY, G.A., MEDEIROS, A.A. A functional classification scheme for β-lactamases and its correlation with molecular structure. Antimicrob. Agents Chemother, 39:1211-1233, 1995. 7. CALDER, M.A.; CROUGHAN, M.J.; McLEOD, D.T.; AHMAD, F. The incidence and antibiotic susceptibility of Branhamella catarrhalis in respiratory infections. Drugs, 31:11-16, 1986. 8. CHANOINE-NICOLAS, M.H. Impact of β-lactamases on the clinical use of β-lactam antibiotics. Intern. J. Antimicrob. Agents, 7:21-26, 1996. 9. CHEN, H.Y.; YAUN, M.; IBRAHIM-ELMAGBOUL, I.B.; LIVERMORE, D.M. National survey of susceptibility to antimicrobials amongst clinical isolates of Pseudomonas aeruginosa. J. Antimicrob. Chemother., 274:639-644, 1995. 10. COUNDRON, P.E.; MOLAND, E.S.; SANDERS, C.C. Occorence and detection of extended-spectrum β-lactamases in members of the family Enterobacteriaceae at a Veterans Medical Centers: seek and you may find. J. Clin. Microbiol., 35:2593-2597, 1997. 11. DeCHAMPS, et al. A case control study of an outbreak of infections caused by Klebsiella pneumoniae strains producing CTX-1(TEM-3) b-lactamase. J. Hosp. Infect., 18: 5-13, 1991. 12. DeFLAUN, M.F.; LEVY, S.B. Genes and their varied hosts. In: Levy S.B., Miller, RV. Eds. Gene transfer in the environment. New York, McGraw Hill Publishing, p. 1-32, 1989. 13. DOERN, G.V. et al. National collaborative study of the prevalence of antimicrobial resistance among clinical isolates of Haemophilus influenzae. Antimicrob. Agents Chemother., 32:180-185, 1988. 14. GARAU, J. Beta-lactamases: current situation and clinical importance. Intesive Care Med, 20: 95-99, 1994. 15. HENQUELL, C.; CHANAL, C.; SIROT, D.; LABIA, R.; SIROT, J. Molecular characterization of 9 different types of mutants among 107 inhibitor-resistant TEM (IRT) from clinical isolates of Escherichia coli. Antimicrob. Agents Chemother., 39:427-430, 1995. 16. HONORÉ, N., CHANOINE-NICOLAS, M.H.; COLE, S.T. Regulation of enterobacterial cephalosporinase production in clinical isolates of Enterobacter cloacae is controlled by a regulatory gene that has been deleted from Escherichia coli. EMBO, 5:3709-3714, 1989. 17. JACOBY, G.A.; BUSH, K. Amino acid sequences for TEM, SHV, amd OXA extend-spectrum and inhibitor resistant β-lactamases. (http://www.lahey.org/studies/webt.htm) 18. JACOBY, G.A. Desenvolvimento da resistência em patógenos Gram-negativos. Relatório especial de Hospital Practice “Patógenos emergentes nas doenças infecciosas”, McGraw-Hill Company, p. 14-19, 2000. 19. JACOBY, G.A.; MEDEIROS, A.A. More extended spectrum β-lactamases. Antimicrob. Agents Chemother, 35:1697-1704, 1991. 20. JACOBY, G.A.; SUTTON, I. β-lactamases and β-lactam resistance in Escherichia coli. Antimicrob. Agents Chemother., 28: 703-706, 1985. 21. JARVIS, W.R.; MARTINE, W.J. Predominat pathogens in hospital infections. J. Antimicrob. Chemother., 29:19-24, 1991. 22. KIRBY, W.M.M. Extraction of a highly potent penicillin inactivator from penicillin resistant staphylococci. Science, 99:452-453, 1944. 23. KÖNÖNEM, E. et al. Phylogenetic characterization and proposal of a new pigmented species to the genus Prevotella: Prevotella pallens sp. nov. Int. J Syst. Bacteriol., 48: 47-51, 1998. 24. LACEY, R.W. Antibiotic resistance in Staphylococcus aureus and streptococci. Br. Med. Bull., 40: 77-83, 1984. 25. LEUNG, M.; SHANNON, K.; FNENCH, G. Rarity of transferable β-lactamase production by Klebsiella species. J. Antimicrob. Chemother., 39:737-745, 1997. 26. LINDBERG, F.; NORMARK, S. Contribution of chromosomal β-lactam resistance in enterobacteria. Rev. Infect. Dis., 8:292-304, 1986. 27. LIU, P.Y.F.; et al. Survey of the prevalence of beta-lactamase amongst 1000 gram-negative bacilli isolated consecutively at the Royal London Hospital. J. Antimicrobial Chemother., 30:429-447, 1992. 28. LIVERMORE, D.M. β-lactamases in laboratory and clinical resistance. Clin. Microbiol. Rev., 8:557-584, 1995. 29. LIVERMORE, D.M.; YANG, Y.J. β-lactamase lability and inducer power of newer β-lactam antibiotics in relation to their activity against β-lactamase inducibility mutants of Pseudomonas aeruginosa. J. Infect. Dis., 155:775-782, 1987. 30. LUCET, J.C.; et al. Outbreak of multiply resistant enterobacteriaceae in an intensive care unit: epidemiology and risk factors for acquisition. Clin. Infect. Dis., 22: 430-436, 1996. 31. McGOWAN, J.E.; TENOVER, F.C. Control of antimicrobial resistance in the health care system. Infect. Dis. Clin. North. Am., 11:297-311, 1997. 32. MEDEIROS, A.A. Evolution and dissemination of β-lactamases. Clin. Infect. Dis., 24: 19-45, 1997. 33. MONNET, D.L. et al. Evidence of interhospital transmission of extended-spectrum β-lactam resistant Klebsiella pneumoniae in the United States, 1986 to 1993. Infect. Control. Hosp. Epidemiol., 18: 492-498, 1997. 34. MONTELLI, A.C.; SADATSUNE, T. Antibioticoterapia para o clínico. Sociedade Brasileira de Microbiologia. Rio de Janeiro, p. 7, 2001. 35. MOOSDEEN, F. Impact of β-lactamases on the clinical use of β-lactam antibiotics. In. Viewpoints in Medicine, Countering Resistance due to β-lactamases. Worthing: Cambridge Medical Publications, p. 6-11, 1996. 36. NAKANO, V.; AVILA-CAMPOS, M.J. Survey of antimicrobial susceptibility patterns of the bacteria of the Bacteroides fragilis group isolated from the intestinal tract of children. Mem. Inst. Oswaldo Cruz., 99:319-324, 2004. 37. PATERNSON, D.L. β-lactamases de amplo espectro. Relatório especial de Hospital Practice “Patógenos emergentes nas doenças infecciosas”, McGraw-Hill Company, p. 22-27, 2000. 38. PEÑA, C. et al. Epidemiology and successful control of a large outbreak due to Klebsiella pneumoniae producing extended-spectrum β-lactamases. Antimicrob. Agents Chemother., 42:53-58, 1998. 39. PHILIPPON, A., LABIA, R. JACOBY, G. Extended-spectrum β-lactamases. Antimicrob. Agents Chemother, 33:1131-1136, 1989. 40. PHILIPPON, A.; ARLET, G.; LAGRANGE, P.H. Origin and impact of plasmid-mediated extend-spectrum β-lactamases. Eur. J. Clin. Microbiol. Infect. Dis., 13:517-529, 1994. 41. PIROTH, L. et al. Spread of extended-spectrum β-lactamase producing Klebsiella pneumoniae are β-lactamase inhibitors of therapeutic value? Clin. Infect. Dis., 27:76-80, 1998. 42. QUINN, J. P. et al. Novel plasmid-mediate β-lactamase (TEM-10) conferring selective resistance to ceftazidime and aztreonam in clinical isolates of Klebsiella pneumoniae. Antimicrob. Agents Chemother., 33: 1451-1456, 1989. 43. RASMUSSEN, B.A.; BUSH, K. Carbapenem hydrolyzing β-lactamases. Antimicrob. Agents Chemother., 41:223-232, 1997. 44. RICE, L.B.; WILEY, S.H.; PAPANICOLAOU, G.A., et al., Outbreak of ceftazidime resistance caused by extended-spectrum β-lactamases at a Massachusets chronic-care facility. Antimicrob. Agents Chemother., 34: 2193-2199, 1990. 45. SCHIAPPA, D.A. et al. Ceftazidime-resistant Klebsiella pneumoniae and Escherichia coli bloodstream infection: a case-control and molecular epidemiologic investigation. J. Infect. Dis., 174: 529-536, 1996. 46. SUMMANEM, P.; BARON, E.J.; CITRON, D.M. Wadsworth Anaerobic Bacteriology Manual. Belmont, CA, Star Publishing Co, 1993. 47. TAVARES, W. Resistência bacteriana. In: Manual de antibióticos e quimioterápicos antiinfecciosos 3ª ed. Atheneu, São Paulo. p. 79, 2001. 48. TENOVER, F.C.; HUGHES, J.M. The challenges of emerging infectious diseases: development and spread of multiply-resistant bacterial pathogens. JAMA, 275:300-304, 1996. 49. VINCENT, J.L.; et al.. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European prevalence of infection in intensive care (EPIC) study. JAMA, 274: 639-644, 1995. 50. WEXLER, H.M.; MOLITORIS, D.; FINEGOLD, S.M. In vitro activity of gatifloxacin against 238 strains of anaerobic bacteria. Anaerobe, 7: 285-289, 2001. 51. WILLIAMS, J.D. β-lactamases and β-lactamase inhibitors. Inter. J. Antimicrob. Agents, 12: 3-7, 1999. Autores: Viviane Nakano (Joven Investigador - Profesor Colaborador) Sheila A. Nishiyama (Doctoranda en Microbiologia) Mario J. Avila-Campos (Profesor Titular del Depto. Microbiologia-ICB-USP)
|