*** Translation of this text not available.
*** Follows the original text in Portuguese.
Antimicrobianos são produtos elaborados durante o metabolismo microbiano capazes de inibir parcial ou totalmente a multiplicação e crescimento de microrganismos. Estas substâncias são classificadas como antibióticos (substâncias químicas produzidas por microrganismos) e como quimioterápicos (substâncias sintetizadas ou produtos microbianos modificados estruturalmente em laboratório). O uso dessas substâncias químicas revolucionou a abordagem das infecções e o seu sucesso gerou grande otimismo em relação à prevenção e ao tratamento dos processos infecciosos. Entretanto, a prescrição nem sempre criteriosa ou racional desses antimicrobianos, rapidamente gerou dificuldades para seu uso, devido à progressiva resistência bacteriana a essas drogas (Montelli & Sadatsune, 2001).
A resistência a agentes antimicrobianos não é um fenômeno recente. A detecção das β-lactamases, tanto em bactérias Gram-positivas quanto em Gram-negativas, remonta-se aos inícios dos anos 40, antes do uso generalizado da penicilina no mundo todo (Abraam & Chain, 1940; Kirby, 1944). A produção de enzimas β-lactamases, tem sido relatada como um importante mecanismo de resistência a antibióticos β-lactâmicos, hidrolisando o anel beta-lactâmico pela quebra da ligação amida, perdendo assim, a capacidade de inibir a síntese da parede celular bacteriana (Williams, 1999). As β-lactamases podem ser detectadas em Enterobacteriaceae, Haemophilus influenza, Neisseria gonorrhoeae, Vibrio cholerae, Pseudomonas aeruginosa, Moraxella spp., (GARAU, 1994) e anaeróbios, tais como as espécies do grupo Bacteroides fragilis, cepas de Prevotella que produzem pigmento, Porphyromonas spp., Bilophila wadsworthia, Fusobacterium spp. e Clostridium spp. (Summanen et al., 1993; Könönen et al., 1998). A produção dessa enzima por um microrganismo explica o porquê da sua sobrevivência em um foco infeccioso, apesar do uso de um antibiótico β-lactâmico. Além disso, a presença desses microrganismos produtores de β-lactamase pode favorecer a sobrevivência de outros microrganismos sensíveis ao antibiótico em um processo infeccioso (Tavares, 2001). O aparecimento e a disseminação de microrganismos com múltipla resistência às drogas estão ocorrendo tanto nos hospitais quanto nas comunidades. Isto pode ser o resultado da interação de vários fatores, sendo talvez o mais importante, a pressão seletiva exercida pelas drogas sobre os microrganismos, dificultando assim, a sua sobrevivência na presença de agentes antimicrobianos (McGowan & Tenover, 1997). Por outro lado, não pode ser esquecida a troca de informações genéticas entre microrganismos, com transferência de genes para novos hospedeiros, e as mutações que podem ocorrer nos genes de resistência ampliando seu espectro de resistência (DeFlaun & Levy, 1989; Tenover & Hughes, 1996). Mutações nos genes de resistência aumentam o espectro de atividade das β-lactamases de amplo espectro ou espectro extendido (ESBL – Extended Spectrum β-lactamases) (Philippon et al., 1989). As enzimas ESBL são capazes de hidrolisar as cefalosporinas de amplo espectro, como a cefotaxima e ceftazidima, e os monobactâmicos, como o aztreonam (Jacoby & Medeiros, 1991). Estudos têm sugerido que a pressão seletiva causada pelo uso constante de cefalosporinas nos centros de saúde contribui para o aparecimento e disseminação desses microrganismos resistentes (Rice et al., 1990; Coundron et al., 1997). Monnet et al. (1997) observaram que a resistência bacteriana causada pela produção de ESBL pode aumentar num período de 2 anos em até 57% em um único hospital. A presença de microrganismos que expressam novas enzimas capazes de hidrolisar carbapenêmicos, como imipenem e meropenem, vem cada vez mais sendo observada (Rasmussen & Bush, 1997). MECANISMOS DE AÇÃOA hidrólise do anel beta-lactâmico do núcleo estrutural das penicilinas - o ácido 6-aminopenicilâmico - provoca a formação do ácido penicilóico desprovido de atividade antimicrobiana. Consequentemente a quebra deste anel nas diversas penicilinas forma derivados do ácido penicilóico, igualmente inativos. De forma similar, ocorre com as cefalosporinas e carbapenêmicos (Tavares, 2001). Os antibióticos beta-lactâmicos são classificados pela semelhança estrutural adicionados de radicais que fornecem a estabilidade dessa droga (Figura 1). 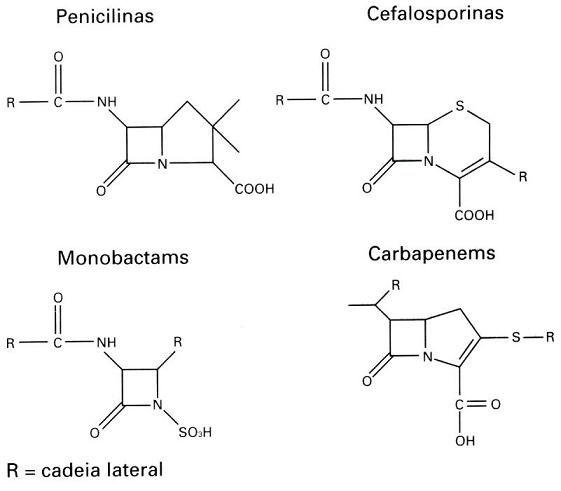
Figura 1. Estrutura dos antibióticos beta-lactâmicos (Williams, 1999). TIPOS DE ENZIMA BETA-LACTAMASESAs β-lactamases podem ser encontradas extracelularmente em bactérias Gram-positivas, ou no espaço periplasmático em bactérias Gram-negativas (Bush, 1988). Os genes que codificam a produção dessas enzimas podem estar localizados no cromossomo bacteriano ou em plasmídeos. As β-lactamases de origem cromossômica são universais em algumas espécies bacterianas, enquanto que, aquelas de origem plasmídial são variáveis, permitindo que esses elementos sejam transferidos entre espécies. A mobilidade genética pode ser ampliada por meio de transposons, os quais transportam os genes da β-lactamase desde os plasmídeos até os cromossomos. Esta mobilidade é importante, pois permite que os genes resistentes se disseminem através das diversas comunidades bacterianas (Williams, 1999). Embora, todas as β-lactamases catalisem a mesma reação, determinados tipos dessas enzimas têm sido isoladas e caracterizadas. Assim, essas enzimas foram classificadas segundo a estrutura primária (classe A à D), e as características funcionais e bioquímicas (grupo I à IV). Enzimas classificadas como classe A ou grupo II, hidrolisam penicilinas e cefalosporinas; classe B ou grupo III, carbapenêmicos; classe C ou grupo I, cefalosporinas; classe D, penicilinas e cloxacilina; e grupo IV (penicilinases de ), penicilina (Ambler, 1980; Bush et al., 1995). Pseudomonas cepacia Os efeitos da enzima variam segundo a distribuição nas diferentes espécies bacterianas, a prevalência de produção da β-lactamase dentro de cada espécie e a prevalência em espécies patogênicas. Considerando-se então, esses três fatores, as enzimas da classe A mediadas por plasmídeos são consideradas as mais importantes por seus efeitos na prática clínica, incluindo-se as ESBL (Nicolas-Chanoine, 1996). As cepas bacterianas que produzem as enzimas da classe A: TEM-1, SHV-1, ROB-1 ou PC-1 são resistentes à amoxicilina e à ticarcilina e apresentam susceptibilidade reduzida a piperacilina (Jacoby & Sutton, 1985; Livermore & Yang, 1987). Essas enzimas são inibidas por outros beta-lactâmicos denominados de inibidores de β-lactamase como sulbactam, tazobactam e ácido clavulânico, assim as cepas que as produzem são sensíveis às associações de antibióticos β-lactâmicos - inibidores de b-lactamase (Livermore, 1995). Entre as enzimas da classe A mediadas por plasmídeos, as penicilinases destacam-se porque ocorrem numa grande variedade de patógenos, incluindo estafilococos, enterococos, Moraxella catarrhalis, Neisseria, Haemophilus, Bacteroides, Pseudomonas, Acinetobacter, e membros da família Enterobacteriaceae (Nicolas-Chanoine, 1996). A maioria (90%) das cepas de Staphylococcus aureus produz penicilinases (Lacey, 1984), e como consequência disso houve o desenvolvimento de novas penicilinas resistentes às beta-lactamases direcionadas ao S. aureus, tais como oxacilina e meticilina. Penicilinases também são produzidas por 9-30% de H. influenzae que causam otite média (Doern et al., 1988) e em 60-80% de M. catarrhalis envolvida em broncopneumonia (Calder et al., 1986). As espécies do grupo Bacteroides fragilis também estão associadas a uma elevada (> 80%) produção dessa enzima (Nakano & Avila-Campos, 2004). Infecções envolvendo estes microrganismos geralmente são tratadas com uma associação de penicilina + inibidor de β-lactamase ou metronidazol, embora a cefoxitina ou carbapenêmicos também possam ser usados (Aldridge et al., 2001; Wexler et al., 2001). Entre as enterobactérias, Escherichia coli é a espécie mais frequentemente encontrada tanto nas infecções adquiridas na comunidade como nas hospitalares. Cerca de 40-50% das E. coli, particularmente aqueles isolados de infecções do trato urinário (ITU) produzem penicilinases (Henquell et al., 1995). As espécies de Klebsiella pneumoniae podem produzir β-lactamases codificadas por cromossomo ou por plasmídeo (Liu et al., 1992). Entre os outros membros da família Enterobacteriaceae 10% de Enterobacter cloacae produzem penicilinases. Em Pseudomonas aeruginosa que é responsável por 9-12% das infecções hospitalares e nas UTI a prevalência de cepas resistentes à tricarcilina é 10% a 30 % (Vicent et al., 1995; Chen et al., 1995). Já as β-lactamases da classe C são produzidas por vários membros da família Enterobacteriaceae, incluindo as espécies Enterobacter e Serratia, Morganella morganii, Citrobacter freundii e Acinetobacter baumannii, assim como P. aeruginosa e E. coli produz cefalosporinase, mas essa enzima manifesta-se de maneira constitutiva, em níveis baixos e não apresenta ação contra os antibióticos β-lactâmicos. De modo inverso, a produção da cefalosporinase em outras espécies, pode ser induzida e regulada por proteínas ativadoras ou repressoras (Lindberg & Normark, 1986; Honoré et al., 1989). (Lindberg & Normark, 1986; Jarvis & Martine, 1991). Entretanto, o impacto dessas enzimas na terapia antibacteriana varia de acordo com seu modo de expressão. Por exemplo, As cefalosporinas de amplo espectro com uma cadeia lateral oximino, tais como cefotaxima, ceftazidima e ceftriaxona, e o monobactâmico aztreonam, foram lançadas nos anos 60 visando-se a ação contra os patógenos Gram-negativos, porque essas drogas não eram hidrolisadas pelas β-lactamases de origem plasmidial. Entretanto, em pouco tempo foi relatada a presença de isolados clínicos resistentes a um ou mais desses antibióticos, que poderiam propagar esta resistência através de plasmídeos transmissíveis e que eram capazes de hidrolisar oximino-β-lactâmicos. As enzimas envolvidas foram chamadas de β-lactamases de espectro estendido (ESBLs) derivadas de enzimas mediadas por plasmídeos (Medeiros, 1997). Várias β-lactamases de origem plasmidial são produzidas por patógenos Gram-negativos, porém a enzima mais comum é a TEM-1. A β-lactamase TEM-1 tem sido considerada uma enzima totalmente eficiente (Bush et al., 1995). Hidrolisa a penicilina e os derivados de penicilina, tais como ampicilina, carbenicilina e piperacilina. É também bastante ativa contra a cefalotina e a cefuroxima, porém apresenta atividade insignificante contra cefotaxima, ceftazidima, ceftriaxona ou aztreonam, e não possui nenhuma ação contra as cefamicinas (cefoxitina ou cefotetan). O TEM-1 possui um isotipo menos comum, chamado de TEM-2, uma enzima com propriedades cinéticas idênticas, porém com a diferença de possuir um único aminoácido, que muda o ponto isoelétrico (pI) da proteína de 5,4 a 5,6. Na espécie K. pneumoniae a enzima chamada SHV-1 é o tipo mais comum encontrado nos plasmídeos e é também determinada por genes cromossômicos (Leung et al., 1997). A enzima SHV-1 possui 68% de aminoácidos idênticos aos do TEM-1 e um pI de 7,6. O grupo OXA contém uma série menos comum de β-lactamases codificados por plasmídeos, caracterizadas por hidrolisar oxacilina, floxacilina e meticilina, mas que não apresentam qualquer atividade contra os substratos oximino, TEM-1, TEM-2 e SHV-1. As enzimas do grupo OXA, são rapidamente inibidas pelo ácido clavulânico, sulbactam e tazobactam (Jacoby, 2000). Atualmente, são conhecidas 61 ESBL na família TEM-1, 12 na família SHV e 6 na família OXA. Elas são tão numerosas que foi criado uma página na Internet para documentar as suas propriedades ( www.lahey.org/studies/webt.htm). www.lahey.org/studies/webt.htm). As enzimas ESBL foram observadas inicialmente em bacilos Gram-negativos isolados em pacientes da Europa e foram logo em seguida encontrados nos Estados Unidos (Quinn et al., 1989). Atualmente, essas enzimas são descritas em nível mundial (Philippon et al., 1994). Este tipo de resistência é comum, principalmente em K. pneumoniae e, em menor grau, em E. coli. Porém, as ESBLs também são encontradas em Citrobacter diversus, C. freundii, E. cloacae, Enterobacter aerogenes, Proteus mirabilis, P. aeruginosa, K. oxytoca, S. marcescens e Salmonella spp. (Jacoby, 2000). INIBIDORES DE BETA-LACTAMASESDuas estratégias bacterianas têm sido utilizadas para superar a resistência dos beta-lactâmicos à β-lactamase. A primeira é a modificação da estrutura do antibiótico de forma que não haja mais substrato para a enzima hidrolisar, e a segunda pela inibição da enzima por um composto que seja estruturalmente relacionado ao substrato beta-lactâmico (Moosdeen, 1996). Os inibidores de β-lactamase são estruturalmente semelhantes às penicilinas, retendo a ligação amida do grupo beta-lactâmico, mas possuem uma cadeia lateral modificada (Figura 2). Tais aspectos estruturais permitem aos inibidores ligar-se irreversivelmente às β-lactamases como substratos suicidas, mantendo-as inativas. Atualmente, três inibidores de β-lactamase são frequentemente usadas na clínica médica, sulbactam, tazobactam e ácido clavulânico (Williams, 1999). 
Figura 2. Estrutura dos inibidores de β-lactamase (WILLIAMS, 1999). A combinação de um agente β-lactâmico e um inibidor de β-lactamase tem mostrado ser uma boa opção de tratamento, já que o inibidor inativará a ação da enzima permitindo que as penicilinas, as quais são eficientes e bem toleradas continuem a tratar as mais variadas infecções (Williams, 1999). IMPORTÂNCIA CLÍNICA DAS BETA-LACTAMASESA incidência crescente da produção de β-lactamases por patógenos presentes na comunidade como em hospitais, tem exercido um impacto considerável na maneira de prescrever os antimicrobianos. No tratamento de infecções comuns adquiridas pela comunidade tais como infecções do trato urinário (ITU), otite média ou broncopneumonia, o uso de penicilinas tem diminuído, aumentando assim, o uso de associações de penicilinas ou cefalosporinas de segunda e terceira geração com algum inibidor de b-lactamase (Nicolas-Chanoine, 1996). Os microrganismos produtores de ESBL ocorrem com frequência em surtos e causam um dilema terapêutico devido ao padrão de resistência a múltiplas drogas. Esses microrganismos também causam uma preocupação com o controle da infecção devido à disseminação de cepas de paciente para paciente, e pelo aparecimento de cepas policlonais devido à transmissão de elementos genéticos entre cepas e gêneros distintos de bacilos Gram-negativos (Patterson, 2000). As características epidemiológicas dos surtos de ESBL têm sido estudadas por vários pesquisadores. Dentre os fatores de risco associados à aquisição de microrganismos que produzem ESBL, podemos citar o uso de cateteres (arterial, venoso central e urinário), colonização intestinal, duração da estada na UTI ou mesmo no hospital, administração anterior de ceftazidima ou aztreonam, cirurgia abdominal de emergência e assistência ventilatória (DeChamps et al., 1991; Schiappa et al., 1996; Lucet et al., 1996; Piroth et al., 1998). Medidas para controlar surtos foram relatadas incluindo a restrição ao uso de oximino-beta-lactâmico (especialmente ceftazidima) e um controle rígido das infecções com ênfase nos cuidados de barreira e lavagem das mãos. O trato intestinal é um reservatório de microrganismos que produzem ESBL, assim, a descontaminação intestinal tem sido também usada para o controle de surtos nas UTI (Brun-Buisson et al., 1989; Peña et al., 1998). A avaliação dos tratamentos para o combate às infecções devido aos microrganismos que produzem ESBL é complicada pela diversidade dos tipos dessa enzima e pela variedade de fatores que podem modificar sua expressão. Os resultados podem ser influenciados pelo tipo de infecção e dependendo se o paciente está efetivamente infectado ou apenas colonizado. Frequentemente os pacientes estão infectados com vários patógenos necessitando de múltiplos agentes antimicrobianos. Também, é importante mencionar que, trocas significativas de uso de antibióticos também exercem uma pressão seletiva para novos microrganismos resistentes (Jacoby, 2000). CONCLUSÕESNa era dos antibióticos, as β-lactamases mostraram ser extremamente adaptáveis. Apareceram em novos hospedeiros, mudaram sua expressão para níveis mais altos, alteraram sua susceptibilidade aos inibidores e aumentaram o leque de seus substratos. Os principais tipos moleculares das β-lactamases nos patógenos Gram-negativos são codificados por genes localizados em plasmídeos conjugáveis ou transposons, facilitando assim, a disseminação da resistência aos β-lactâmicos, mas também promovendo a co-seleção em relação a outros antibióticos. As bactérias são capazes de evolução rápida em resposta à pressão seletiva exercida pelo uso generalizado de antibióticos, e assim, as mudanças continuadas observadas nas características das β-lactamases não devem ser surpresas.  REFERÊNCIAS1. ABRAAM, E.P.; CHAIN, E. An enzyme from bacteria able to destroy penicillin. Nature, 146: 837, 1940. 2. ALDRIDGE, K.E.; ASHCRAFT, D.; CAMBRE, K.; PIERSON, C.L.; JENKINS, S.G.; ROSENBLATT, J.E. Multicenter survey of the changing in vitro antimicrobial susceptibility of clinical isolates of Bacteroides fragilis group, Prevotella, Fusobacterium, Porphyromonas, and Peptostreptococcus species. Antimicrob. Agents Chemother., 45:1238-1243, 2001. 3. AMBLER, R.P. The structure of b-lactamases. Philos. Trans. R. Soc. London Ser., 27: 321-331, 1980. 4. BRUN-BUISSON, C. et al. Intestinal decontamination for control of nosocomial multiresistant gram-negative bacilli: study of an outbreak in an intensive care unit. Ann. Intern. Med., 110: 873-881, 1989. 5. BUSH, K. b-lactamase inhibitors from laboratory to clinic. Clin. Microbiol. Rev., 1: 109-123, 1988. 6. BUSH, K., JACOBY, G.A., MEDEIROS, A.A. A functional classification scheme for b-lactamases and its correlation with molecular structure. Antimicrob. Agents Chemother, 39:1211-1233, 1995. 7. CALDER, M.A.; CROUGHAN, M.J.; McLEOD, D.T.; AHMAD, F. The incidence and antibiotic susceptibility of Branhamella catarrhalis in respiratory infections. Drugs, 31:11-16, 1986. 8. CHANOINE-NICOLAS, M.H. Impact of β-lactamases on the clinical use of β-lactam antibiotics. Intern. J. Antimicrob. Agents, 7:21-26, 1996. 9. CHEN, H.Y.; YAUN, M.; IBRAHIM-ELMAGBOUL, I.B.; LIVERMORE, D.M. National survey of susceptibility to antimicrobials amongst clinical isolates of Pseudomonas aeruginosa. J. Antimicrob. Chemother., 274:639-644, 1995. 10. COUNDRON, P.E.; MOLAND, E.S.; SANDERS, C.C. Occorence and detection of extended-spectrum β-lactamases in members of the family Enterobacteriaceae at a Veterans Medical Centers: seek and you may find. J. Clin. Microbiol., 35:2593-2597, 1997. 11. DeCHAMPS, et al. A case control study of an outbreak of infections caused by Klebsiella pneumoniae strains producing CTX-1(TEM-3) b-lactamase. J. Hosp. Infect., 18: 5-13, 1991. 12. DeFLAUN, M.F.; LEVY, S.B. Genes and their varied hosts. In: Levy S.B., Miller, RV. Eds. Gene transfer in the environment. New York, McGraw Hill Publishing, p. 1-32, 1989. 13. DOERN, G.V. et al. National collaborative study of the prevalence of antimicrobial resistance among clinical isolates of Haemophilus influenzae. Antimicrob. Agents Chemother., 32:180-185, 1988. 14. GARAU, J. Beta-lactamases: current situation and clinical importance. Intesive Care Med, 20: 95-99, 1994. 15. HENQUELL, C.; CHANAL, C.; SIROT, D.; LABIA, R.; SIROT, J. Molecular characterization of 9 different types of mutants among 107 inhibitor-resistant TEM (IRT) from clinical isolates of Escherichia coli. Antimicrob. Agents Chemother., 39:427-430, 1995. 16. HONORÉ, N., CHANOINE-NICOLAS, M.H.; COLE, S.T. Regulation of enterobacterial cephalosporinase production in clinical isolates of Enterobacter cloacae is controlled by a regulatory gene that has been deleted from Escherichia coli. EMBO, 5:3709-3714, 1989. 17. JACOBY, G.A.; BUSH, K. Amino acid sequences for TEM, SHV, amd OXA extend-spectrum and inhibitor resistant β-lactamases. (http://www.lahey.org/studies/webt.htm) 18. JACOBY, G.A. Desenvolvimento da resistência em patógenos Gram-negativos. Relatório especial de Hospital Practice “Patógenos emergentes nas doenças infecciosas”, McGraw-Hill Company, p. 14-19, 2000. 19. JACOBY, G.A.; MEDEIROS, A.A. More extended spectrum β-lactamases. Antimicrob. Agents Chemother, 35:1697-1704, 1991. 20. JACOBY, G.A.; SUTTON, I. β-lactamases and β-lactam resistance in Escherichia coli. Antimicrob. Agents Chemother., 28: 703-706, 1985. 21. JARVIS, W.R.; MARTINE, W.J. Predominat pathogens in hospital infections. J. Antimicrob. Chemother., 29:19-24, 1991. 22. KIRBY, W.M.M. Extraction of a highly potent penicillin inactivator from penicillin resistant staphylococci. Science, 99:452-453, 1944. 23. KÖNÖNEM, E. et al. Phylogenetic characterization and proposal of a new pigmented species to the genus Prevotella: Prevotella pallens sp. nov. Int. J Syst. Bacteriol., 48: 47-51, 1998. 24. LACEY, R.W. Antibiotic resistance in Staphylococcus aureus and streptococci. Br. Med. Bull., 40: 77-83, 1984. 25. LEUNG, M.; SHANNON, K.; FNENCH, G. Rarity of transferable β-lactamase production by Klebsiella species. J. Antimicrob. Chemother., 39:737-745, 1997. 26. LINDBERG, F.; NORMARK, S. Contribution of chromosomal β-lactam resistance in enterobacteria. Rev. Infect. Dis., 8:292-304, 1986. 27. LIU, P.Y.F.; et al. Survey of the prevalence of beta-lactamase amongst 1000 gram-negative bacilli isolated consecutively at the Royal London Hospital. J. Antimicrobial Chemother., 30:429-447, 1992. 28. LIVERMORE, D.M. β-lactamases in laboratory and clinical resistance. Clin. Microbiol. Rev., 8:557-584, 1995. 29. LIVERMORE, D.M.; YANG, Y.J. β-lactamase lability and inducer power of newer β-lactam antibiotics in relation to their activity against β-lactamase inducibility mutants of Pseudomonas aeruginosa. J. Infect. Dis., 155:775-782, 1987. 30. LUCET, J.C.; et al. Outbreak of multiply resistant enterobacteriaceae in an intensive care unit: epidemiology and risk factors for acquisition. Clin. Infect. Dis., 22: 430-436, 1996. 31. McGOWAN, J.E.; TENOVER, F.C. Control of antimicrobial resistance in the health care system. Infect. Dis. Clin. North. Am., 11:297-311, 1997. 32. MEDEIROS, A.A. Evolution and dissemination of β-lactamases. Clin. Infect. Dis., 24: 19-45, 1997. 33. MONNET, D.L. et al. Evidence of interhospital transmission of extended-spectrum β-lactam resistant Klebsiella pneumoniae in the United States, 1986 to 1993. Infect. Control. Hosp. Epidemiol., 18: 492-498, 1997. 34. MONTELLI, A.C.; SADATSUNE, T. Antibioticoterapia para o clínico. Sociedade Brasileira de Microbiologia. Rio de Janeiro, p. 7, 2001. 35. MOOSDEEN, F. Impact of β-lactamases on the clinical use of β-lactam antibiotics. In. Viewpoints in Medicine, Countering Resistance due to β-lactamases. Worthing: Cambridge Medical Publications, p. 6-11, 1996. 36. NAKANO, V.; AVILA-CAMPOS, M.J. Survey of antimicrobial susceptibility patterns of the bacteria of the Bacteroides fragilis group isolated from the intestinal tract of children. Mem. Inst. Oswaldo Cruz., 99:319-324, 2004. 37. PATERNSON, D.L. β-lactamases de amplo espectro. Relatório especial de Hospital Practice “Patógenos emergentes nas doenças infecciosas”, McGraw-Hill Company, p. 22-27, 2000. 38. PEÑA, C. et al. Epidemiology and successful control of a large outbreak due to Klebsiella pneumoniae producing extended-spectrum β-lactamases. Antimicrob. Agents Chemother., 42:53-58, 1998. 39. PHILIPPON, A., LABIA, R. JACOBY, G. Extended-spectrum β-lactamases. Antimicrob. Agents Chemother, 33:1131-1136, 1989. 40. PHILIPPON, A.; ARLET, G.; LAGRANGE, P.H. Origin and impact of plasmid-mediated extend-spectrum β-lactamases. Eur. J. Clin. Microbiol. Infect. Dis., 13:517-529, 1994. 41. PIROTH, L. et al. Spread of extended-spectrum β-lactamase producing Klebsiella pneumoniae are β-lactamase inhibitors of therapeutic value? Clin. Infect. Dis., 27:76-80, 1998. 42. QUINN, J. P. et al. Novel plasmid-mediate β-lactamase (TEM-10) conferring selective resistance to ceftazidime and aztreonam in clinical isolates of Klebsiella pneumoniae. Antimicrob. Agents Chemother., 33: 1451-1456, 1989. 43. RASMUSSEN, B.A.; BUSH, K. Carbapenem hydrolyzing β-lactamases. Antimicrob. Agents Chemother., 41:223-232, 1997. 44. RICE, L.B.; WILEY, S.H.; PAPANICOLAOU, G.A., et al., Outbreak of ceftazidime resistance caused by extended-spectrum β-lactamases at a Massachusets chronic-care facility. Antimicrob. Agents Chemother., 34: 2193-2199, 1990. 45. SCHIAPPA, D.A. et al. Ceftazidime-resistant Klebsiella pneumoniae and Escherichia coli bloodstream infection: a case-control and molecular epidemiologic investigation. J. Infect. Dis., 174: 529-536, 1996. 46. SUMMANEM, P.; BARON, E.J.; CITRON, D.M. Wadsworth Anaerobic Bacteriology Manual. Belmont, CA, Star Publishing Co, 1993. 47. TAVARES, W. Resistência bacteriana. In: Manual de antibióticos e quimioterápicos antiinfecciosos 3ª ed. Atheneu, São Paulo. p. 79, 2001. 48. TENOVER, F.C.; HUGHES, J.M. The challenges of emerging infectious diseases: development and spread of multiply-resistant bacterial pathogens. JAMA, 275:300-304, 1996. 49. VINCENT, J.L.; et al.. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European prevalence of infection in intensive care (EPIC) study. JAMA, 274: 639-644, 1995. 50. WEXLER, H.M.; MOLITORIS, D.; FINEGOLD, S.M. In vitro activity of gatifloxacin against 238 strains of anaerobic bacteria. Anaerobe, 7: 285-289, 2001. 51. WILLIAMS, J.D. β-lactamases and β-lactamase inhibitors. Inter. J. Antimicrob. Agents, 12: 3-7, 1999. Autores: Viviane Nakano (Jovem Pesquisador - Professor Colaborador) Sheila A. Nishiyama (Doutoranda em Microbiologia) Mario J. Avila-Campos (Responsável pelo Laboratório de Anaeróbios)
|